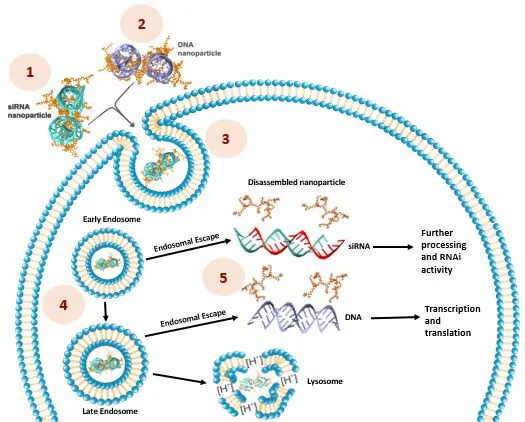
製品概要
各トランスフェクション試薬の特長
All-Fect Prime-Fect Leu-Fect A & B Trans-Booster In Vivo DNA-Fect In Vivo RNA-Fect mRNA-Fect CRISP-Fect
All-Fect
siRNA pDNAトランスフェクション試薬として設計されており、siRNAによるノックダウンやプラスミドDNAのトランスフェクション、siRNAとpDNAの同時輸送に使用できます。All-Fectは、特に臍帯血・骨髄由来の間葉系幹細胞や、高度に分化した平滑筋細胞、内皮細胞での使用に適しています。
資料をダウンロード:All-Fect Brochure
試薬の特徴:
高効率のトランスフェクション
血清の存在下で従来製品の2-3倍の効力を発揮します。
シンプルなプロトコル
トランスフェクション中に組織の培養液を交換する必要がありません。
毒性が低い
市販のトランスフェクション試薬より毒性が低く、正常な細胞の生理活性の維持に優れています。
リファレンス:
Hsu and Uludağ. Biomaterials (2012) 33: 7834-7848.
Remant Bahadur et al., J. Materials Chemistry B (2015) 3: 3972-3982.
Wang et al., J. Surgical Research (2013) 183: 8-17.
写真:臍帯血由来の間葉系幹細胞にGFPプラスミドをトランスフェクションした際に見られた、All-Fectの典型的な性能。この実験ではAll-Fectと他社のリポフェクション試薬をそれぞれの最適条件下で使用し、性能を比較しています。導入遺伝子の発現の度合いは、任意単位でのEGFPの発現度合いに基づいてフローサイトメトリーにより測定されました。上の写真は、トランスフェクション後のGFPの発現を示す典型的な蛍光顕微鏡像を示しています。
Prime-Fect
この製品は初代細胞へのプラスミドDNAのトランスフェクション用に設計されています。Prime-Fectは接着細胞へのプラスミドDNA輸送用に開発された製品ですが、接着細胞へのsiRNA輸送や浮遊細胞へのプラスミドのトランスフェクションにも効果的です。
資料をダウンロード:Prime-Fect Brochure
試薬の特徴:
高効率のトランスフェクション
初代細胞への使用において、血清の存在下で従来製品の2-3倍の効力を発揮します。
シンプルなプロトコル
トランスフェクション中に組織の培養液を交換する必要がありません。
毒性が低い
リポフェクション試薬より低毒性で、細胞の生理活性の変化を最小限に抑えます。
リファレンス:
KC et al., J. Materials Chemistry B (2015) 3: 3972-3982.
(A) Prime-Fectを用いてトランスフェクションされた骨髄間質細胞。GFPがプラスミドを用いて導入され、トランスフェクションの2日後に蛍光顕微鏡を用いて分析されました。細胞に関連するDNAが赤色で標識されています。
Leu-Fect A & B
これらの製品は浮遊細胞へのトランスフェクション用途に合わせて設計されており、特にsiRNAの輸送に適しています。Leu-Fect AとLeu-Fect Bの2種類の試薬があり、それぞれが異なるタイプの浮遊細胞に効果的です。実験で使用される細胞で両試薬の効果を試し、適した試薬を選んでいただくことをお勧めいたします。
資料をダウンロード:Leu-Fect A Brochure Leu-Fect B Brochure
試薬の特徴:
高効率のトランスフェクション
血清の存在下で従来製品の2-3倍の効力を発揮します。
シンプルなプロトコル
トランスフェクション中に組織の培養液を交換する必要がありません。
毒性が低い
リポフェクション試薬より低毒性で、細胞の生理活性の変化を最小限に抑えます。
リファレンス:
Gul-Uludag et al. Leukemia Research (2014) 38: 1299–1308.
Landry et al. J. Controlled Release (2016) 224: 8-21.
Valencia-Serna et al. J. Controlled Release (2013) 172: 495-503.
(A) in vitroでのK562細胞および(B) in vivoでのK562腫瘍組織へのLeu-Fect / FAM-siRNA複合体の取り込み。
Trans-Booster
この製品は接着細胞や浮遊細胞へのプラスミドDNAトランスフェクションの効率を高める用途で設計されています。トランスフェクション効率を高めることで、目的の用途のためのタンパク質大量生産や、必要なDNAやトランスフェクション試薬の量を減らすことも可能になります。Trans-Boosterは、細胞タイプによってはsiRNAやmicroRNAなど他の核酸を用いる際にも効果的です。
資料をダウンロード:Trans-Booster Brochure
試薬の特徴:
高効率のトランスフェクション
一般的なトランスフェクション試薬の存在下で、2-3倍の効力を発揮します。
シンプルなプロトコル
トランスフェクション中に組織の培養液を交換する必要がありません。
毒性が低い
リポフェクション試薬やポリマー性の試薬より低毒性で、トランスフェクション後の細胞からのタンパク質収量が上がります。
安全性
室温で長期保存が可能です。
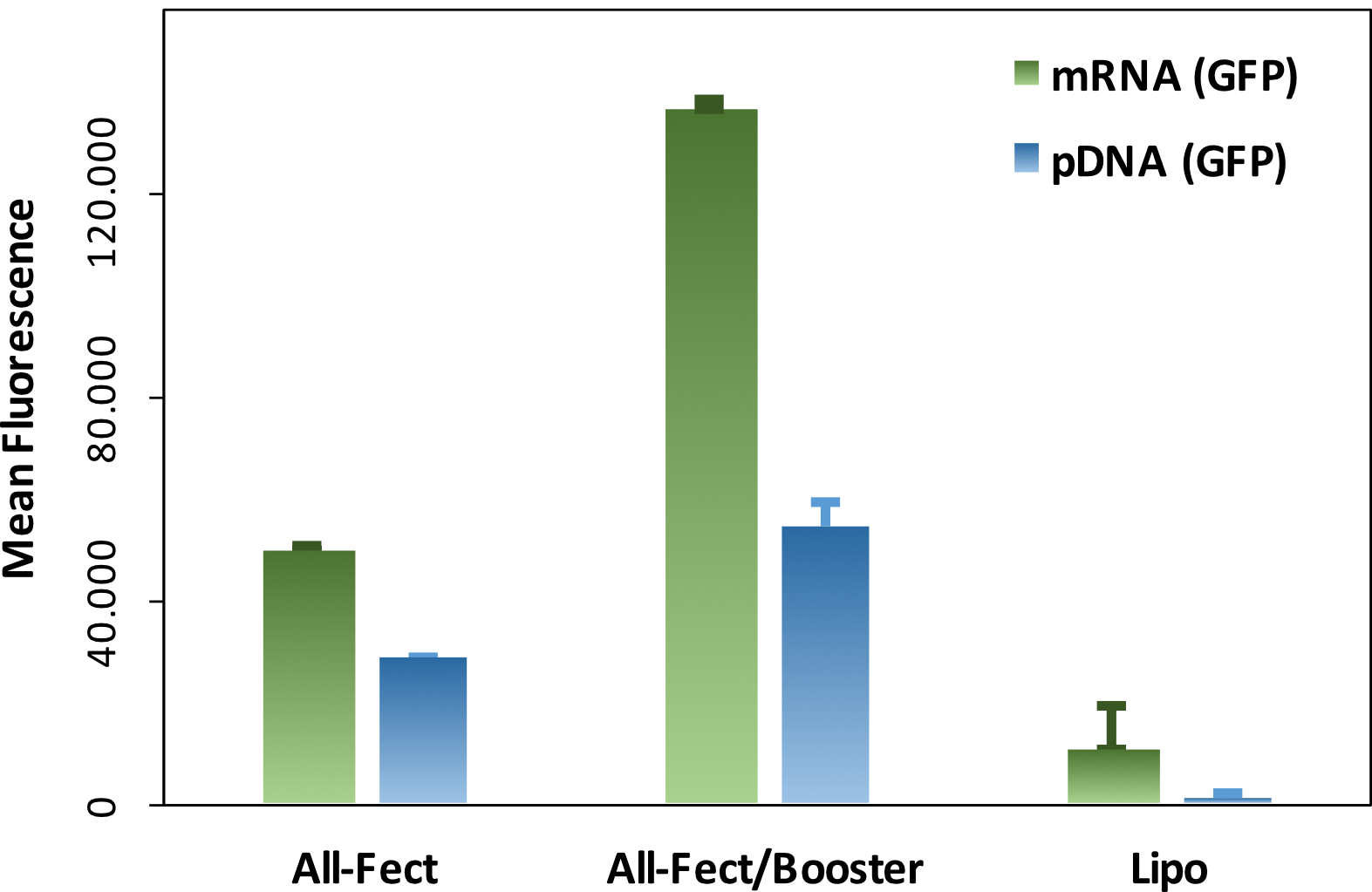
グラフ:浮遊Jurkat細胞でのトランスフェクションにおける、Trans-Boosterの典型的な性能。トランスフェクション処理中にTrans-Boosterを用いて、または用いずに、Jurkat細胞へのGFPプラスミドとGFP mRNAのトランスフェクションが行われました。この実験では、RJH社製のAll-Fectと他社製のリポフェクション試薬が比較されています。導入遺伝子の発現の度合いはフローサイトメトリーによって測定され、任意単位の平均GFP蛍光としてまとめられています。mRNAとプラスミドDNAのどちらのタイプのGFP発現においても、Trans-Boosterはトランスフェクション効率の顕著な上昇をもたらしています。
In Vivo DNA-Fect
この製品は動物モデルへのプラスミドDNAの輸送用に設計されています。In Vivo DNA-Fectは市販のPEIベースのin vivo用試薬よりもトランスフェクション効率が高く、費用対効果が高い代替品となります。従来の試薬は、その毒性によって導入遺伝子の発現が制限されたり、投薬された箇所の周辺の生理反応が変化するなどしてしまうために、利用が限定されていました。In Vivo DNA-Fectはその生体適合性によって、細胞の生理機能の変化を最小化し、発現した導入遺伝子をより良く応答させます。
資料をダウンロード:In Vivo DNA-Fect Brochure
試薬の特徴:
高効率のトランスフェクション
血清の存在下で従来製品の2-3倍の効力を発揮します。
シンプルなプロトコル
生理食塩水などのシンプルな処方で投与することが可能です。
毒性が低い
従来のトランスフェクション試薬より低毒性で、トランスフェクション後の細胞からのタンパク質収量が上がります。
リファレンス:
Rose et al., Biomaterials Science (2014) 2: 833-842.
Rose et al., Biomaterials (2012) 33: 3363-3374.
写真:ラットの皮下組織に2種のGFPプラスミドをそれぞれトランスフェクションした際に見られた、In Vivo DNA-Fectの典型的な性能。実験では、In Vivo DNA-Fectと分岐鎖PEI (PEI25; 25 kDa)を、それぞれの複合体をゼラチンスポンジに移植してから14日後に比較しています。導入遺伝子の発現は、移植片に蛍光顕微鏡を用いて組織学的に分析されました。
In Vivo RNA-Fect
この製品はマウス腫瘍モデルへのsiRNA輸送用に設計されています。特定箇所(例:腫瘍内)への直接投与にも、体系的(例:腹腔内投与、静脈内投与)にも使用できます。In Vivo RNA-Fectは、市販のPEIベースのin vivo用試薬よりも費用対効果が高い代替品となります。毒性が低いため、正常な動物モデルの健康に影響を与えることなく、核酸をより多く投与することが可能です。
資料をダウンロード:In Vivo RNA-Fect Brochure
試薬の特徴:
リファレンス:
Aliabadi et al., J. Controlled Release (2013) 172: 219-228.
Alshamsan et al., Translational Oncology (2011) 4: 178-188.
Abbasi et al., Pharmaceutical Research (2011) 28: 2516-2529.
グラフ:In Vivo RNA-Fectを用いてsiRNAを導入した腫瘍の生育結果。未処理の腫瘍と、コントロールsiRNA・治療用siRNAをIn Vivo RNA-Fectを用いて導入された腫瘍が比較されました。(A) 腫瘍内注射、(B) 腹腔内注射。
mRNA-Fect
この製品は、mRNAを接着細胞・浮遊細胞どちらにも輸送できるように設計された商品です。mRNA-Fectは特定の細胞タイプへのプラスミドDNA・siRNAの輸送に対して効果的であることが検証されております。特定の細胞タイプでの試薬の効果を試して、適した組成を選んでいただくことをお勧めいたします。
資料をダウンロード:mRNA-Fect Brochure
試薬の特徴:
高効率のトランスフェクション
血清の存在下で従来製品の2-7倍の効力を発揮します。
シンプルなプロトコル
トランスフェクション中に組織の培養液を交換する必要がありません。
毒性が低い
リポフェクション試薬より低毒性で、細胞の生理活性の変化を最小限に抑えます。
画像: mRNA-Fectを用いたmRNAのトランスフェクション。(A) 接着MCF-7細胞とMDA-MB-436細胞、MDA-MB-231細胞へのトランスフェクション。
CRISP-Fect
この製品はCRISPER-Cas9 RNPを様々な接着細胞や浮遊細胞に輸送する用途で設計されています。詳細や適用した細胞タイプでのデータ例は、以下の「詳細情報 」からご覧ください。
特定の細胞タイプでの試薬の効果を試して、適した組成を選んでいただくことをお勧めいたします。一般的な最適化プロトコルはRJH社のResources Page にございます。また、全商品に適用される細胞タイプもResources Pageでご確認いただけます。CRISP-Fectのプロトコルは以下のCRISP-Fect Brochureからご覧ください。
資料をダウンロード:CRISP-Fect Brochure
試薬の特徴:
高効率のトランスフェクション
血清の存在下で従来製品の2-7倍の効力を発揮します。
シンプルなプロトコル
トランスフェクション中に組織の培養液を交換する必要がありません。
毒性が低い
リポフェクション試薬より低毒性で、細胞の生理活性の変化を最小限に抑えます。
グラフ:(左上)CRISP-Fectを用いたJurkat T細胞と乳癌MDA-MB-436細胞へのトランスフェクション。sgRNA/Cas9複合体(RNP)がCRISP-Fectを用いて処理され、24時間細胞に添加されました。RNPの吸収はFITCで標識されたCas9によって追跡されました。結果は任意単位の蛍光として要約され、細胞あたりに輸送されたRNPの平均値が示されました。(右上)RNP陽性細胞の割合
製品の特徴
RJH社は、プラスミドDNAやsiRNA、mRNA、その他の核酸を用いて哺乳類細胞を改変するために、幅広く活用できるトランスフェクション試薬を開発いたしました。RJH社のトランスフェクション試薬の基盤となっているのは、正電荷と疎水性(脂質)グループのバランスが最適な陽イオン性の脂質のポリマーです。ポリマーの骨格と脂質グループの性質を体系的に変えることで、トランスフェクション試薬のライブラリが作成されました。ある種のトランスフェクション試薬は異なる細胞種や核酸で幅広く機能し、他の種類の試薬は特定の細胞種へ特定の核酸運搬に非常に効果的に機能します。
RJH社の輸送体の利点:
核酸との多価の相互作用 によってカーゴの強固な結合が形成され、細胞膜を通過する際の破壊的作用に耐える陽イオン性と脂質性の結合による相乗効果 によりカーゴが覆われ、ヌクレアーゼから保護される脂質成分 により、細胞膜との相互作用や細胞内への輸送が促されるpH緩衝能 によりエンドソームからのカーゴの脱出が促される細胞質内に移行したフリーの核酸が目的に合わせて処理される
トランスフェクション試薬は以下の細胞モデルや用途に最適化されています。選択ガイド も併せてご覧ください。
初代細胞
接着細胞
VSMC (Vascular Smooth Muscle Cells)
HUVEC (Human Umbilical Vein Endothelial Cells)
Human Foreskin Fibroblast Cells
BMSC (Bone Marrow Stromal Cells)
Human Myoblasts
Rat Primary Sympathetic Neurons
浮遊細胞
UCB-MSC (Umbilical Cord Blood Derived Mesenchymal Stem Cells)
BM-MSC (Bone Marrow Derived Mesenchymal Stem Cells)
Mononuclear Cells from Leukemia Patients
Mononuclear Cells from Normal Human Blood
細胞株
接着細胞
293-T (Kidney Fibroblast Cells)
MDA-231 (Breast Cancer Cells)
MDA-436 (Breast Cancer/ Melanoma Cells)
MDA-468, Sum-149PT, MCF-7 (Breast Cancer Cells)
A549 (Human Lung Cancer Cells)
MDCK (Kidney Epithelial Cells)
HCT-116 (Human Colon Cancer Cells)
C2C12 Myoblast Cells
MC3T3-1 (Preosteoblast Cells)
Green Monkey Vero Cells
浮遊細胞
U-937 (Human Lymphoma Cells)
K562 (Chronic Myeloid Leukemia Cells)
KG1, KG1A and THP-1 (Acute Myeloid Leukemia Cells)
Jurkat T-Cells
動物モデル
Systemic and local injection of RNAi mediator siRNA
Local injection of pDNA and mRNA expression vectors
上へ戻る
サービスの背景
RJH Biosciences社の研究開発の焦点
RJH社の注力する焦点の1つは、短鎖干渉RNA(siRNA)のデリバリーによるRNA干渉(RNAi)を実用化することです。RNAiは様々ながんや疾病の治療に用いられていますが、同社での初めての治療利用は血液がんです。他の焦点は、免疫療法で使用される、治療タンパク質を元来の位置で発現させるプラスミドDNA(pDNA)の直接投与です。
血液がんと核酸療法を用いた免疫療法を研究する理由
血液がんには白血病、リンパ腫、骨髄腫の3種類があります。白血病は、白血球の増殖能が高く、異常であるという特徴があります[1]。リンパ腫と骨髄腫はそれぞれ、免疫系に大きな影響を与えるリンパ系と形質細胞のがんです[2,3]。これら3つのがんは治療が難しく、現在の治療は特に末期がんにおいて、効果が限られています。
核酸に基づいた治療の利用は、RNAi技術と細胞に基づいた免疫治療の2つの主な方法で、これらのがんを根絶することができます。RNAiの利用は、血液がんの治療においてますます研究されています。siRNAのようなポリヌクレオチドはがん遺伝子の下方制御を補助し、個人に特異的な異常を治療するように設計され、普遍的な治療デザインと共に、個別化治療戦略として用いられます[4]。血液がん治療におけるsiRNAの可能性により、同社はがん遺伝子を標的にし、また、悪性細胞にてアポトーシスを誘導するsiRNA治療に現在注力しています。
血液がんの治療をするために研究されている他の戦略は、免疫療法の利用です。免疫治療の戦略は、抗体、幹細胞移植、サイトカイン、低分子の利用です[5]。 しかし、より最近のアプローチは、細胞移入療法(CTT)としても知られる遺伝子操作された細胞を利用する遺伝子治療です。この方法は、T細胞やB細胞、NK細胞などといった患者自身の免疫細胞を使います。免疫細胞のゲノムは、免疫細胞表面でのネオアンチゲンの発現と提示に関わる様々な免疫療法の戦略をサポートするように操作され、そしてホストへ再導入されます[5]。 遺伝子操作された細胞は最終的に、悪性細胞を標的にし、排除するように設計されています。この戦略には、血液系でT細胞が悪性細胞を‘探し出し’、破壊することができるので、高いアドバンテージがあります。このアプローチは血液がんで有望である一方で、他の固形がんでも使うことができます。免疫療法の基礎は患者の細胞への核酸の導入に依存するので、効果的な核酸のデリバリーが成功に必要不可欠です。同社のトランスフェクション試薬は、そのようなデリバリーを請け負う最高クラスの運搬体です。
核酸療法に基づくナノ医療は、がんオーダーメイド治療と免疫療法において、大きな要素です。RJH Biosciences社は、同社またはお客様のどちらの核酸であっても、上質なトランスフェクション試薬をご提供することに励みます。
References
Jean, C. and Dick, J. (2005) Cancer stem cells: lessons from leukemia. Trends in cell biology. 15, 494-501.
Woods, N. et al. (2006) Therapueti gene causing lymphoma. Nature. 440, 1123.
Mahindra, A. et al. (2012) Latest advances and current challenges in the treatment of multiple myeloma. Nature Reviews Clinical Oncology. 9, 135-143.
Uludağ, H. et al. (2016) Current attempts to implement siRNA-based RNAi in leukemia models. Drug Discovery Today. 21, 1412-1420.
Zou, W. (2006) Regulatory T cells, tumour immunity and immunotherapy. Nature Reviews Immunology. 6, 295-307.
上へ戻る
製品一覧
All-Fect
幅広い種類の細胞に対応している、pDNAやsiRNAの輸送または同時輸送用の試薬
カタログ番号
製品名
容量
濃度
Trans-Booster
10-10 All-Fect
0.75 mL
1 mg/mL
–
10-20 All-Fect
1.5 mL
1 mg/mL
–
10-40 All-Fect Kit
0.75 mL
1 mg/mL
0.75 mL at 0.4 mg/mL
10-50 All-Fect Kit
1.5 mL
1 mg/mL
1.5 mL at 0.4 mg/mL
10-60 ALL-Fect In Vivo Kit
1 mL
5 mg/mL
1 mL at 2 mg/mL
RJH社 製品ページ:siRNA, microRNA and ASO Delivery
mRNA-Fect
mRNAの輸送に最適な、高効率のトランスフェクション試薬
カタログ番号
製品名
容量
濃度
Trans-Booster
80-10 mRNA-Fect
0.75 mL
1 mg/mL
–
80-20 mRNA-Fect
1.5 mL
1 mg/mL
–
80-30 mRNA-Fect In Vivo
1 mL
5 mg/mL
–
80-40 mRNA-Fect Kit
0.75 mL
1 mg/mL
0.75 mL at 0.4 mg/mL
80-50 mRNA-Fect Kit
1.5 mL
1 mg/mL
1.5 mL at 0.4 mg/mL
80-60 mRNA-Fect In Vivo Kit
1 mL
5 mg/mL
1 mL at 2 mg/mL
RJH社 製品ページ:mRNA Transfection Reagents
CRISP-Fect
接着細胞や浮遊細胞へのリボ核タンパク質(RNP)の輸送に最適な、高効率のトランスフェクション試薬
カタログ番号
製品名
容量
濃度
Trans-Booster
90-10 CRISP-Fect
0.75 mL
1 mg/mL
0.75 mL at 0.4 mg/mL
90-20 CRISP-Fect
1.5 mL
1 mg/mL
1.5 mL at 0.4 mg/mL
RJH社 製品ページ:CRISPR Transfection Reagents
上へ戻る
トランスフェクション試薬の選択ガイド
以下の表は、細胞タイプ・核酸ごとに適したトランスフェクション試薬をまとめたものです。トランスフェクション試薬の効果は、プラスミドDNA (pDNA)、低分子干渉RNA (siRNA)、メッセンジャーRNA (mRNA)、マイクロRNA (miR)、アンチセンスオリゴヌクレオチド (ASO)、Cas9/sgRNAリボヌクレオプロテイン (RNP)を用いて評価されています。
細胞用
細胞タイプ
All-Fect Leu-Fect-A Leu-Fect-B Prime-Fect mRNA-Fect CRISP-Fect
初代細胞
臍帯血由来間葉系幹細胞 (UCB-MSC)
pDNA
pDNA
mRNA
骨髄由来間葉系幹細胞 (BM-MSC)
pDNA
pDNA
mRNA
血管平滑筋細胞 (VSMCs)
pDNA
pDNA
mRNA
ヒト臍帯静脈内皮細胞 (HUVECs)
pDNA
mRNA
健常人および白血病患者の単核細胞 (CML, AML, ALL)
siRNA
siRNA
mRNA
ヒト包皮線維芽細胞
pDNA
pDNA
mRNA
ラットの一次交感神経ニューロン
pDNA
mRNA
細胞株
腎臓線維芽細胞 (293-T)
pDNA
pDNA
腎臓上皮細胞 (MDCK)
siRNA
乳がん/黒色腫細胞 (MDA-MB-436)
pDNA, siRNA
siRNA
mRNA
RNP
乳がん細胞 (MDA-MB-231, MDA-MB-468, Sum-149PT, MCF-7)
pDNA, siRNA
siRNA
mRNA
RNP
ヒトリンパ腫細胞 (U-937)
pDNA
pDNA
慢性骨髄性白血病細胞 (K562)
siRNA, miR
mRNA
急性骨髄性白血病細胞 (KG1, KG1A, THP-1, MV4-11, MOLM-13)
siRNA
mRNA
急性リンパ性白血病 (RS;4-11)
siRNA
ヒト肺がん細胞 (A549, Calu-3, H1975)
pDNA, siRNA
siRNA
mRNA
ヒト大腸がん (HCT-116)
pDNA
siRNA
mRNA
ヒト筋芽細胞
ASO
Jurkat細胞
pDNA
mRNA
神経細胞株 N2A-97Q
pDNA
siRNA
pDNA
mRNA
動物モデル用
設定
All-Fect Leu-Fect-A Leu-Fect-B mRNA-Fect
宿主組織内への局所的な注射
pDNA
siRNA
siRNA
mRNA
全身性の注射 (IV, SC, IP)
pDNA
siRNA
siRNA
mRNA
局所的な移植 (親細胞に最適化された試薬)
pDNA
siRNA
siRNA
mRNA
全身性の移植 (親細胞に最適化された試薬)
pDNA
siRNA
siRNA
mRNA
マトリクスと共に移植
pDNA
mRNA
※ 試薬は、げっ歯類モデルを用いて上記の設定でテストされています。移植モデルは、マウス内で局所的(皮下)または静脈内注射後に全身的に増殖したヒト細胞(異種移植)に基づいています。
上へ戻る
資料
Q&A
1 細胞の種類に合わせて最善の試薬を選ぶ方法は?第1段階として、RJH社は、興味のある細胞が既に使用されているか確認するために、
トランスフェクション試薬選択ガイド を参照することをご提案します。お客様の細胞の種類がリストに載っていない場合、類似の細胞 (接着依存/浮遊又は樹立した細胞株/初代細胞)に最適化された試薬をお使いになるか、
東京未来スタイル にお問合せください。
2 購入した後、自分で試薬を最適化する必要がありますか?また、どのように行えば良いですか?同社は、トランスフェクション試薬の性能を最適化するために、小規模の予備実験を行うことを推奨しております。一般的なトランスフェクション試薬と同様に、複合体の形成、細胞の播種密度、培養とインキュベーションの条件が最終結果に影響を及ぼします。トランスフェクションの最適化について、同社のテクニカル・シートを参照ください。
さらに詳しく
3 トランスフェクションのプロトコルはどこで確認できますか?
4 トランスフェクション試薬と核酸の複合体を用意するには、どの血清フリーの培地を使うべきですか? 同社のトランスフェクション試薬は、DMEM、RPMI、MEMなどを含む広い範囲の血清フリーの培地で使用できます。複合体は血清含有培地で機能します。
5 複合体を形成させるには、どのくらいのトランスフェクション試薬と核酸(DNA及び/又はRNA)が必要ですか? 推奨する核酸とトランスフェクション試薬の比率は、比較的有毒の試薬の場合で1:1 (w/w)から、生体に適した試薬の場合で5~20:1となります。この比率は用途ごとに最適化されなければなりません。各試薬の推奨する範囲は、それぞれの試薬のマニュアルをご参照ください。
6 トランスフェクションを行った後に複合体を除去する必要がありますか?いいえ。処理した細胞から複合体を取り除く必要はありません。複合体は細胞と共に分析の終わりまで培養中に残しても構いません。
7 意図した効果を確認するためには、細胞とトランスフェクション複合体をどのくらい培養すれば良いですか?用途によって、インキュベーション時間は2時間から24時間で変わります。トランスフェクションの工程を加速させ、複合体のインキュベーション時間を最小限にするために、細胞を遠心分離することも可能です。
8 細胞の種類に対するトランスフェクション効率はどのように測定できますか?トランスフェクション効率は異なるアプローチで測定できます。GFPやRFPといったレポーター遺伝子は、顕微鏡またはフローサイトメトリー技術の使用でトランスフェクションを評価するために便利な方法です。誘導された遺伝子産物(例: ELISAやウェスタンブロットによって)、または、抑制された遺伝子の発現(タンパク質またはmRNAの濃度)の直接的な評価は重要です。機能的な結果をトランスフェクションの間接的な測定に使用することも可能ですが、この場合は複雑な要因に注意が必要です。全ての研究において、研究されている核酸に類似したコントロール(いわゆる非活性)試薬を使うことをお勧めします。
9 トランスフェクション効率をさらに向上させるにはどうすればいいですか?
10 実験における細胞毒性をどのように減らせられますか?全てのトランスフェクション試薬は、使用する量に依存してある程度の細胞毒性を示します。顕著な細胞の生理学的崩壊なしでトランスフェクションを行うことが重要です。不要な曝露を減らすために、トランスフェクションの複合体に曝露される時間を最小限にし、遠心分離によってトランスフェクションの工程をスピードアップさせ、試薬/核酸の濃度を最適化することができます。核酸の純度も不測の毒性を排除するためには重要です。
11 細胞の密度(もしくはコンフルエンス)と継代数はトランスフェクションに影響を及ぼしますか?これらは、トランスフェクション効率に影響を及ぼす重要な基準です。一般的に、細胞密度と継代数が増加すると、細胞が老化し、トランスフェクション効率は減少します。他のトランスフェクション効率に影響を与える因子については、
‘トランスフェクションを向上させるテクニカルチップ’ をご参照ください。
12 トランスフェクション試薬はどのように保管すべきですか?また、保管期間はどのくらいですか?推奨する保管温度は4℃(短期間)または-20℃(長期間)です。試薬は上記の条件下で1年安定するよう設計されています。
13 1 mlチューブでトランスフェクションが何回できますか?同社は核酸とトランスフェクションを1:5の比率で使うことを推奨しているので、1 mlチューブ(1 mg)は1 mgの核酸を200回トランスフェクションすることに適しています。しかし、最適な比率は用途と細胞の種類によって変わります。
14 生体内用の試薬を生体外の実験に使用できますか?はい。同社の生体内用のトランスフェクション試薬は広い活性を示すので、生体外の条件下でも効果があります。
15 異なる種類の核酸に同一の試薬を使用できますか?同社のトランスフェクション試薬には、異なる核酸に機能する製品もあります。これは全てに当てはまることではないですが、大半の試薬は異なる核酸を処理するようです。ALL-Fectトランスフェクション試薬はDNAとRNAの両方を処理します。
16 RJH社の試薬の背景にはどのような技術がありますか?同社の試薬は、陽イオンと疎水性の最適なバランスに基づいており、多価相互作用を通じて核酸と相互作用する重合体です。これらの試薬は核酸の陰イオンの有効な濃縮を提供する一方で、哺乳類の細胞において若干の毒性を示します。
17 執筆中の論文に貴社の製品をどのように引用すれば良いでしょうか?トランスフェクション試薬の調達元を示すために、試薬の名前とRJH Biosciences Inc(Edmonton, AB, Canada)から入手したことを記載してください。
上へ戻る